Page 176 - A Magyar Kardiológusok Társasága 2024. évi Tudományos Kongresszusának programja, az elhangzó előadások kivonatai
P. 176
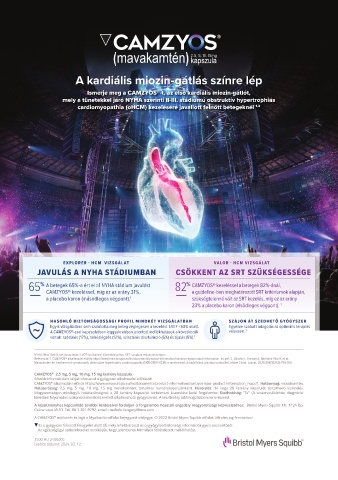
A kardiális miozin-gátlás színre lép
Ismerje meg a CAMZYOS®-t, az első kardiális miozin-gátlót,
mely a tünetekkel járó NYHA szerinti II-III. stádiumú obstruktív hypertrophiás
cardiomyopathia (oHCM) kezelésére javallott felnőtt betegeknél 1,2
EXPLORER - HCM VIZSGÁLAT VALOR - HCM VIZSGÁLAT
JAVULÁS A NYHA STÁDIUMBAN CSÖKKENT AZ SRT SZÜKSÉGESSÉGE
65 % A betegek 65%-a ért el ≥1 NYHA stádium javulást 82 % CAMZYOS® kezeléssel a betegek 82%-ánál,
CAMZYOS® kezeléssel, míg ez az arány 31%, a guideline-ban meghatározott SRT kritériumok alapján,
a placebo karon (másodlagos végpont). 1 szükségtelenné vált az SRT kezelés, míg ez az arány
23% a placebo karon (elsődleges végpont). 1
HASONLÓ BIZTONSÁGOSSÁGI PROFIL MINDKÉT VIZSGÁLATBAN SZÁJON ÁT SZEDHETŐ GYÓGYSZER
Egyik vizsgálatban sem szakította meg beteg véglegesen a kezelést LVEF <50% miatt. Egyénre szabott adagolás az optimális terápiás
A CAMZYOS®-szal kapcsolatban leggyakrabban jelentett mellékhatások a következők válaszért. 1
voltak: szédülés (17%), nehézlégzés (12%), szisztolés diszfunkció (5%) és ájulás (5%). 1
NYHA: New York Heart Association; LVOT: bal kamrai kiáramlási pálya; SRT: szeptum redukciós terápia
Referencia: 1. CAMZYOS® alkalmazási előírás:https://www.ema.europa.eu/hu/documents/product-information/camzyos-eparproduct-information_hu.pdf; 2. Olivotto I, Oreziak A, Barriales-Villa R, et al.
Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER-HCM): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2020;396(10253):759-769.
CAMZYOS ® 2,5 mg, 5 mg, 10 mg, 15 mg kemény kapszula
Bővebb információért kérjük olvassa el a gyógyszer alkalmazási előírását!
CAMZYOS ® alkalmazási előírás https://www.ema.europa.eu/hu/documents/product-information/camzyos-epar-product-information_hu.pdf. Hatóanyag: mavakamtén.
Hatáserősség: 2,5 mg, 5 mg, 10 mg, 15 mg mavakamtént tartalmaz keménykapszulánként. Kiszerelés: 14 vagy 28 kemény kapszulát tartalmazó kiszerelés.
Magyarországon mindegyik hatáserősségnek a 28 kemény kapszulát tartalmazó kiszerelése kerül forgalomba. Kiadhatóság: “Sz” (A szakorvosi/kórházi diagnózist
követően folyamatos szakorvosi ellenőrzés mellett alkalmazható gyógyszerek). A készítmény ártámogatásban nem részesül.
A készítményhez kapcsolódó további kérdéseivel forduljon a forgalomba hozatali engedély magyarországi képviseletéhez: Bristol Myers Squibb Kft. 1124 Bp.
Csörsz utca 49-51. Tel.: 06 1 301-9797, email: medinfo.hungary@bms.com
A CAMZYOS ® márkanév és logó a MyoKardia vállalat bejegyzett védjegye. © 2022 Bristol Myers Squibb vállalat. Minden jog fenntartva!
Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását.
Az egészségügyi szakembereket arra kérjük, hogy jelentsenek bármilyen feltételezett mellékhatást.
3500-HU-2400005
Lezárás dátuma: 2024. 02. 12.